- Programmbereich 1
Zellbiologie

- Chronische Entzündung
- Gedächtnis-Lymphozyten
- Immunologisches Gedächtnis
Wie macht das Immunsystem die rheumatische Entzündung chronisch?
„Kinderkrankheiten“ bekommen wir in der Regel nur einmal. Danach schützen uns bestimmte Immunzellen, die Gedächtnis-Lymphozyten, ein Leben lang. Rheumatische Entzündungen werden durch Gedächtnis-Lymphozyten verursacht, die den eigenen Körper angreifen. Wir untersuchen, wie diese Gedächtnis-Lymphozyten die Entzündung chronisch machen, warum sie auf heutige Therapien nicht oder nur schlecht ansprechen, und wie man sie gezielt ausschalten kann. Ziel ist es, das Immunsystem der Patienten die rheumatische Entzündung vergessen zu lassen.
Über uns
Einen Hinweis, wie (rheumatische) chronische Entzündungen entstehen können, liefert der schwere Krankheitsverlauf bei COVID-19 Patienten, die über längere Zeit intensiv-medizinisch betreut werden müssen. In Zusammenarbeit mit der AG Mashreghi haben wir die Immunantwort dieser Patienten untersucht. Die frühe, durch SARS-CoV-2 induzierte, und gegen das Virus gerichtete akute Immunreaktion geht dabei in eine chronische Immunreaktion über, die nicht mehr gegen das Virus gerichtet ist, sondern vermutlich gegen den Patienten selbst. Wenn bei dieser Immunreaktion Gedächtnis-Lymphozyten gebildet werden, deren Überleben unabhängig von der Entzündung ist, wird die Entzündung chronisch und sie wird nicht mehr auf Therapien ansprechen, die akute Immunreaktionen unterdrücken.
Eine zentrale Rolle bei Entzündungen, die durch Antikörper verursacht werden, z.B. beim systemischen Lupus erythematodes (SLE), spielt die von uns entdeckte Gedächtnis-Plasmazelle, die Autoantikörper produziert, über viele Jahre. Patienten mit solch schädlichen Gedächtnis-Plasmazellen können auch heute nicht in eine Therapie-freie Remission (Heilung) gebracht werden, bestenfalls können bei ihnen die Krankheitssymptome unterdrückt werden, weil die Gedächtnis-Plasmazellen nicht auf herkömmliche Therapien reagieren und unbeirrt weiter ihre Antikörper produzieren. Wir suchen nach Wegen, diese Zellen therapeutisch anzugehen. Wir untersuchen, wo und wie diese Zellen im Körper (über)leben. Sie sind vor allem im Knochenmark und im entzündeten Gewebe zu finden, wo sie an bestimmte Bindegewebszellen andocken. Die Plasmazellen brauchen den Kontakt zur Bindegewebszelle, um am Leben zu bleiben. Jetzt wollen wir wissen, wie das funktioniert. Wir untersuchen wie die Kontakte aufgebaut sind, wie sie das Überleben der Plasmazellen ermöglichen, und ob sie sich bei schützenden und schädlichen Plasmazellen unterscheiden. So können sich erstmals Möglichkeiten ergeben, schädliche Plasmazellen auszuschalten und die Ursache von chronischen, Antikörper-getriebenen, rheumatischen Entzündungen zu beseitigen.
Die Vorläufer der Gedächtnis-Plasmazellen sind die Gedächtnis-B Lymphozyten, die außerdem auch noch chronische Immunreaktionen der Entzündung kontrollieren, zusammen mit den Gedächtnis-T-Lymphozyten. Für die Fachwelt überraschend konnten wir jetzt erstmals zeigen, dass die meisten Gedächtnis-B Lymphozyten ebenso wie die Gedächtnis-Plasmazellen im Knochenmark zu finden sind, dort ebenfalls an Bindegewebszellen andocken und eben nicht im Blut durch den Körper wandern. Wir vermuten, dass sie auch auf ähnliche Weise am Leben erhalten werden, und deshalb gegen konventionelle Therapien resistent sind. Noch überraschender ist, dass wir viele verschiedene Arten von Gedächtnis-B Lymphozyten identifizieren konnten. Zu welcher Art die schädlichen Gedächtnis-B Lymphozyten bei Rheumapatienten gehören, versuchen wir nun herauszufinden, um dann ebenfalls nach Wegen zu suchen, sie gezielt anzugehen.
Zusammen mit den Gedächtnis-B-Lymphozyten kontrollieren die Gedächtnis-T-Lymphozyten Immunreaktionen, insbesondere die Entstehung von Gedächtnis-Plasmazellen, aber auch Zytokin-vermittelte chronische Entzündungen, die unabhängig von Antikörpern sind. Das konnten wir sehr deutlich nachweisen bei der Juvenilen Idiopathischen Arthritis (JIA), also Rheuma bei Kindern. Die schädlichen Gedächtnis-T-Lymphozyten finden wir vor allem im entzündeten Gewebe selbst, z.B. in den entzündeten Gelenken. Sie steuern dort die Entzündung. Um zu überleben, müssen sie sich an das Entzündungsmilieu anpassen. Wir haben Gene identifiziert, die diese Anpassung ermöglichen, so den Transkriptionsfaktor TWIST1 und die Mikro-RNA miR-148a. Wir konnten jetzt zeigen, dass TWIST1 den Stoffwechsel der Zellen an die Umgebung des entzündeten Gewebes anpasst und über das Anschalten der miR-148a den Tod der Zellen verhindert. In einem Mausmodell der Darmentzündung konnten wir bereits mit „Antagomiren“ gegen mir-148a die schädlichen Gedächtnis-T-Lymphozyten in den Tieren gezielt ausschalten, ohne die schützenden Gedächtnis-T-Lymphozyten zu schädigen. Ein erster Hinweis, dass es tatsächlich möglich ist, schädliche Gedächtnis-T-Lymphozyten therapeutisch gezielt zu eliminieren, über ihre Anpassung an das Milieu der Entzündung.
Team
Gruppenleiter
Prof. Dr. rer. nat Andreas Radbruch
Wissenschaftler:innen
Jun Dong, PhD
PhD Student:innen
Xiangyi Deng
Lukas Heiberger
Jinchan Li
Pedram Mahmoudi
Emilia Schneider
Yu Shen
Zixu Wang
- News
- Publikationen
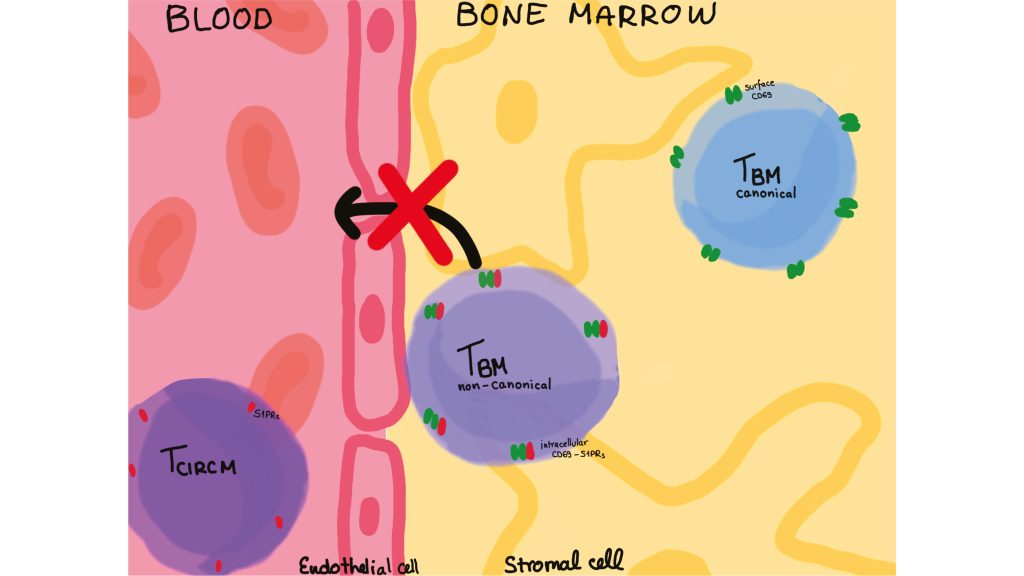
Gewebsständige CD69-negative Gedächtnis-T-Zellen im Knochenmark
Gedächtnis-T-Zellen, die kein CD69 auf der Zelloberfläche tragen, werden im Knochenmark durch Internalisierung von S1PR1 zurückgehalten Gewebeansässige T-Gedächtniszellen spielen eine zentrale Rolle bei entzündlichen rheumatischen…
Gewebsständige CD69-negative Gedächtnis-T-Zellen im Knochenmark